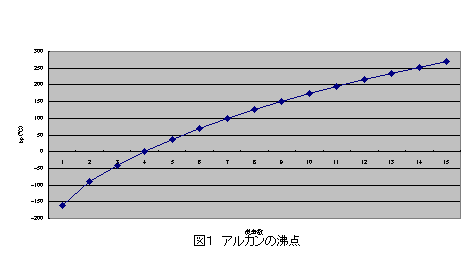
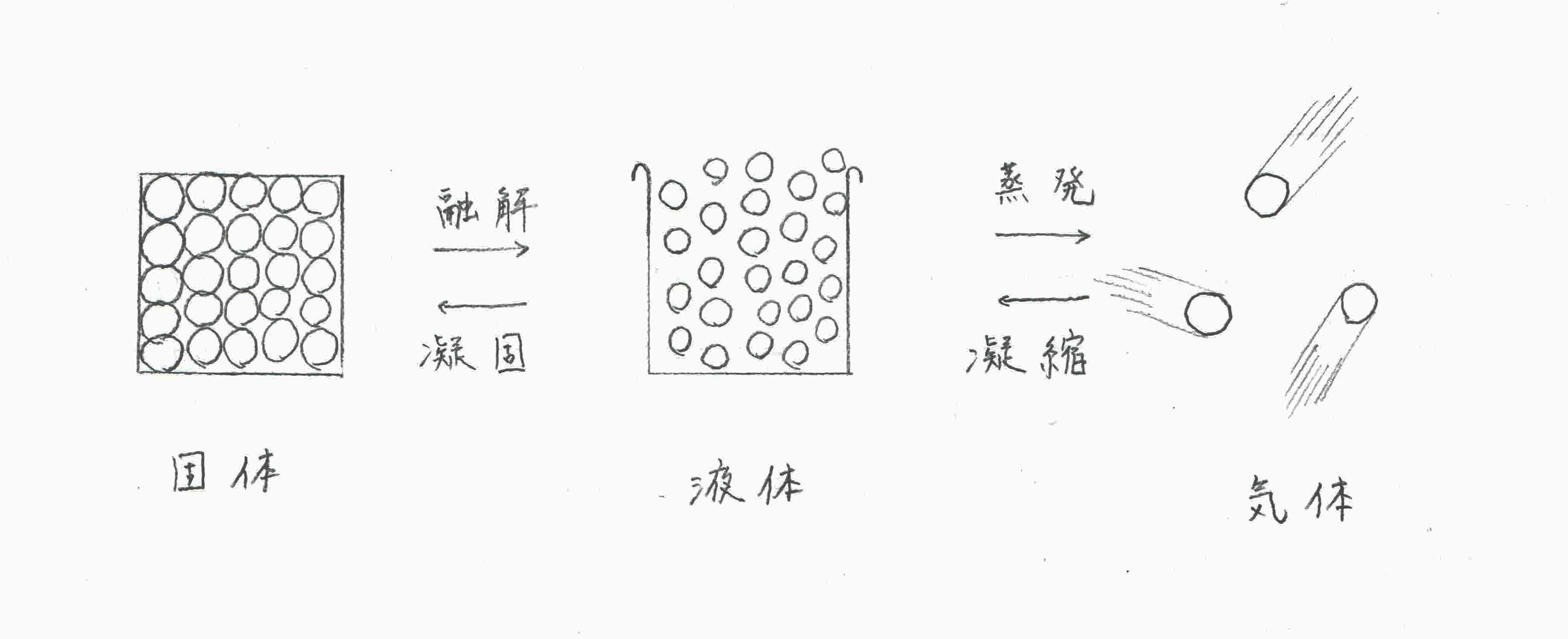
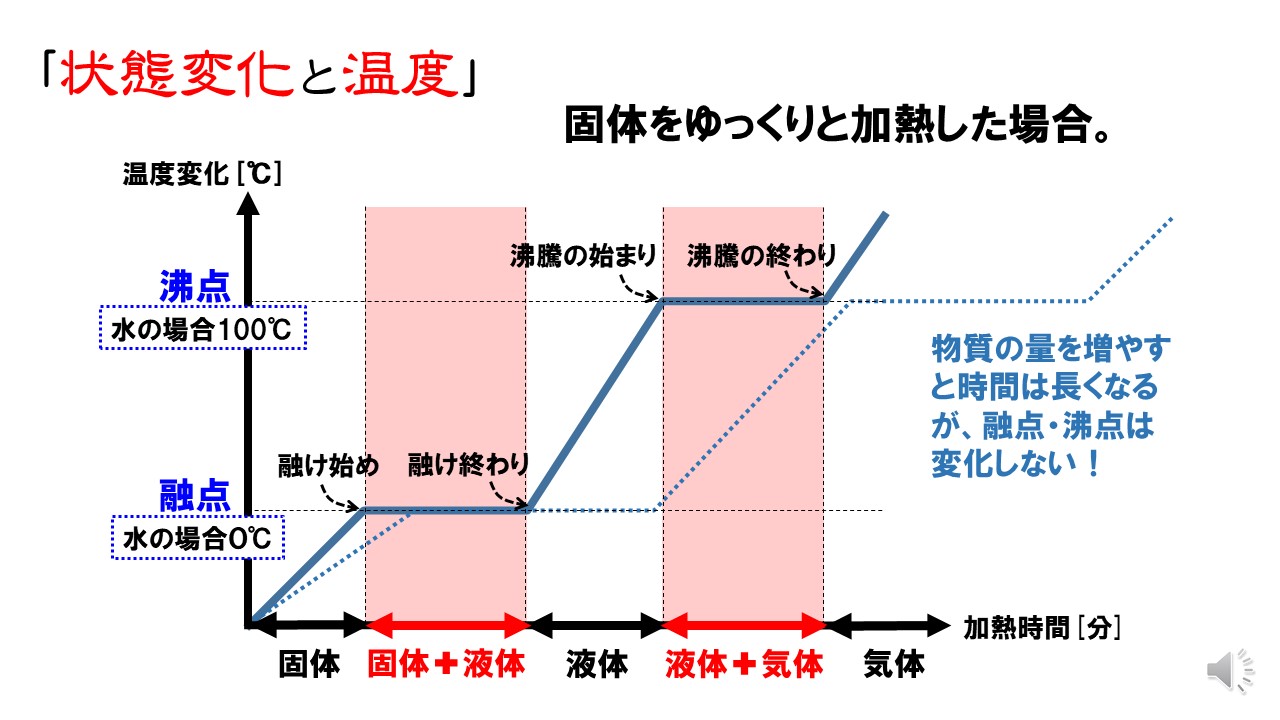
融点 817℃ 沸点 616℃ 密度 573g/cm3 比重 硬度 モース硬度3.5 色、形状 金属色、銀色 ℃、1atmでの状態 固体 線膨張率 (α/106 K1 ) 100K 293K(℃) 500K 800K融点 加熱により 固体 の物質が 液体 になるときの 温度 (固体がとけるときの温度) 沸点 加熱により 液体 の物質が 気体 になるときの 温度 (液体が沸騰するときの温度) 融点や沸点は物質によって決まっている ので、 融点や沸点を測定するとその物質を見分ける手ががりに なります。 ※融点・沸点は状態変化するときの温度なので、冷やされたときまず、沸点について直鎖アルカンの融点は分子量の増加、つまり炭素数の増加に伴って規則的に高くなる。 (図1) これは、分子量が大きくなるに従って、分子の大きさが増大するが、さらに重要なことは分子の表面積が増える。 表面積が増えると分子間の van der waals力が強くなり、分子同士をバラバラに沸騰させるのにより多くのエネルギー(=高温)を必要と

小 中必見 化学を勉強する前に第5弾 物質の三態について 学習内容解説ブログ
融点と沸点の関係 中1
融点と沸点の関係 中1- 密度は227 g/cm3、融点は2967 ℃、沸点は3273 ℃である。 ダイヤモンドと黒鉛の違いに対応するようです。 共有結合性結晶の場合の融点、沸点の意味は食塩の融点、沸点という時とは異なっているはずです。沸点 142 融点785 引火点 25 発火点 360 密度 087 危険物第4類 第2石油類 プロピオン酸メチル Methyl Propionate 沸点 80 融点 引火点2 発火点 469 密度 0915 危険物第4類 第1石油類 トリエタノールアミン Triethanolamine 2,2',2"ニトリロトリエタノール 2,2′,2"Nitrilotriethanol 沸点 360 融点 18 – 21



あれれ この融点沸点のところは大小逆ですか Yahoo 知恵袋
そのため,無極性分子よりも融点・沸点が高くなる。例) F 2 (無極性,分子量 38 ,沸点- 1 ℃)と HCl (極性,分子量 365 ,沸点- 85 ℃)その他,一部の極性分子間には〔 水素結合 〕という結合も生じる。(左下) 分子間力と融点,沸点沸点や融点は物質の種類によって決まった値で、物質の量には関係ない。 物質 融点(℃) 沸点(℃) 鉄 1536 2863 銅 1085 2571 塩化ナトリウム 801 1485 パルミチン酸 63 360 ナフタレン 81 218 メントール 43 217 水 0 100 エタノール 115 78 ブタン 138 05 窒素 210 196 酸素 218 1 融点、沸点が同系列の物質に比べ極端に高い 水は融点、沸点がとても高いという性質があります。 固体にエネルギーを与えると、熱運動が次第に激しくなります。 やがて分子間力より熱運動が大きくなり、もとの位置から動いてしまいます。この現象が融解です。
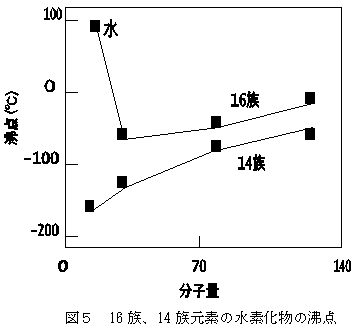
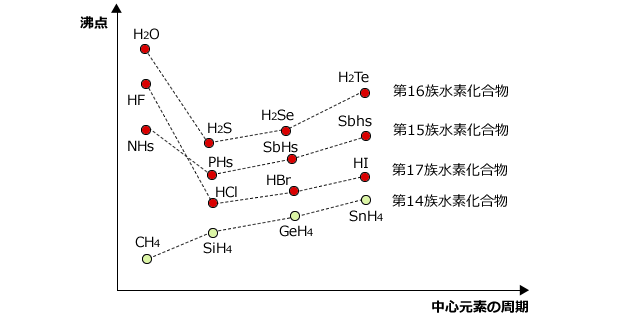
12 水の性質 124 水の注目すべき特性 (3) —融点、沸点— —水の融点、沸点は同系列の他の物質と比較して極端に高い— 水H 2 Oの融点や沸点を、元素の周期表で酸素と同じ16族元素に属する硫黄S、セレンSe、テルルTeの水素化物、すなわち、硫化水素H 2 S元素 記号 融点℃ 沸点℃ 密度 g/cm 3 原子番号 元素名 He 0179 2 ヘリウム H 008 1 水素 Neために多くのエネルギー(熱)を必要とするので,沸点や融点は高くなるのです。 沸点や融点は,物質に含まれる官能基や構造を特定する手がかりとなります。 テーマ4の構造,テーマ7の状態とつなげておさえましょう。 一般に分子構造が似ている分子同士では,分子量が大きくなるほど,分子間力が 大きくなるので,沸点・融点は高くなります。
地表及び大気中に含まれる量が非常に少ないので、このように呼ばれる。 いずれも無味無臭、無色で、1原子分子の気体(常温)である。 融点、沸点は低い。 原子最外殻に非常に安定な電子配置(s2又はs2p6)を持つため化学的に極めて不活性で、元素相互金属の融点、沸点の一覧表 12年12月4日更新 下記の金属の融点、沸点は1気圧での値で、温度の単位は摂氏となります。 金属には常温で液体となっているものや、通常の室温では発火の危険がある特殊なものもありますが、他の工業材料に比し、総じて融点は高いものが多いといえます。 3000℃を超える融点を持つ金属としては、タングステン、オスミウム タングステンの融点は3410 ℃と、どの元素よりも高く、沸点も5657 ℃と高い。タングステンの密度は193 g/cm 3 。37 cmの立方体で1kgの重量にもなる。超高温の環境下で形状の安定性がきわめて高く、ほとんどの化学薬品に侵されにくい特徴を持つ。



色 融点 沸点 硬さ 塩の基本 塩百科 公益財団法人塩事業センター




ヨウ素の沸点 分かりやすさが第一
融点(℃) 沸点(℃) 元素 融点(℃) 沸点(℃) アセチレン 81 1) 84 2) 酢酸水素結合と融点,沸点 ファンデルワール ス力は,分子量と 共に増大する。 すなわち,分子 量の増加につれ て,融点,沸点は 高くなる。 h 2onho,nh 3 はは ,水水 素結合の大きな 分子間力により, 低分子量にもか かわらず,融点, 沸点が高い。 野村良紀・中村吉伸沸点と気化熱を求めることができます。 図2 直鎖アルカンの気化反応測定結果 試料名 測定容器 融点 (℃) 融解熱 (j/g) dsc測定結果 一般的な参考値 dsc測定結果 一般的な参考値 純水 通常 02 00 340 340 特殊 01 00 340 340




中1理科 3分でわかる 沸点と融点の違い Qikeru 学びを楽しくわかりやすく



化学 水素結合の影響 技術情報館 Sekigin 周期表第3周期の窒素 酸素 フッ素の水素化物は 他の水素化物とは異なる沸点 融点 の異常を示す この原因としての水素結合の原理などを紹介
ガドリン石の中から発見された。 化合物としてレーザーに使われている。 融点 1522℃ 沸点 3338℃物質の融点と沸点 Ⅰ 身近なものを用いて状態変化を簡単に観察できる観察・実験例 1 観察・実験のあらまし 物質の融点・沸点の測定をする実験では,温度が正確に求められなかったり,温度上昇が止まら ず融点がわかりにくくなることも多い。 常識を覆す現象! 融点より低い温度で固体が融け出す みなさん、理科の授業で習いましたよね。 物質には 融点 と 沸点 が存在していて、沸点



実験7 凝固点 融点の測定 1年理科 化学 1999 Takaの授業記録




融点と沸点の問題 解答の意味がよくわからなくなりました Clear
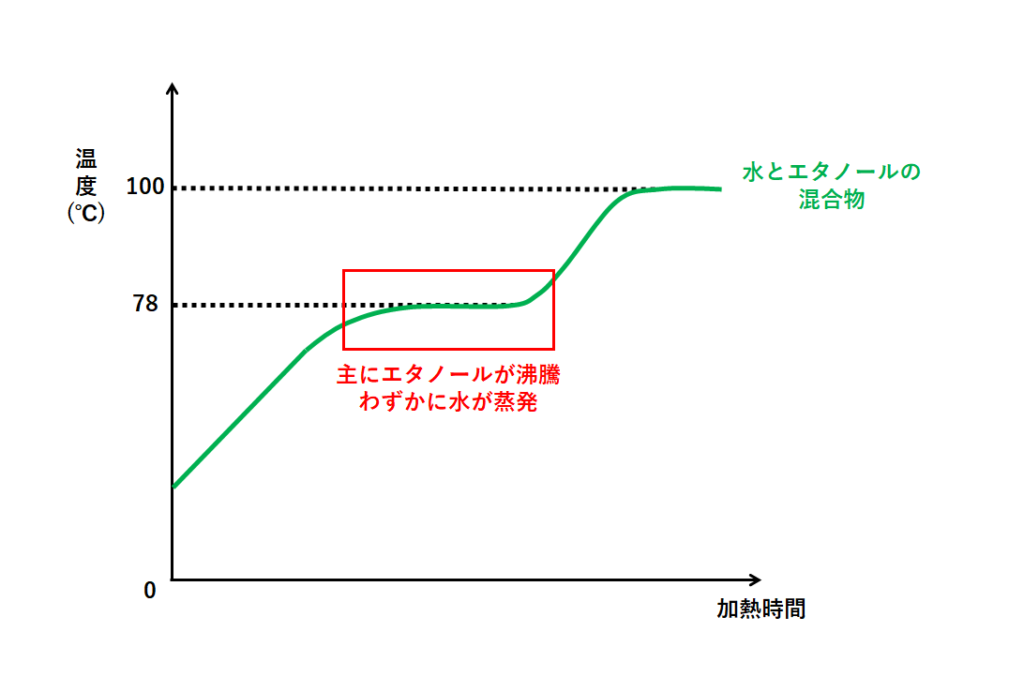
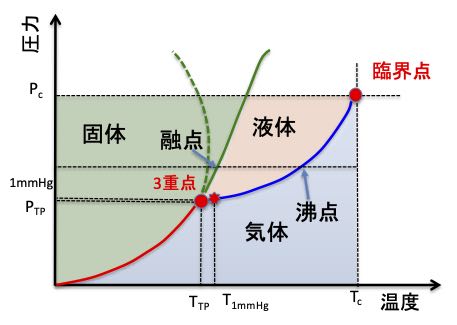
通常融点(凝固点) (T m (T f)) : 外圧が 1 atm のときの融点 水 0℃ 標準融点(凝固点) : 外圧が 1 bar (=0987 atm)のときの融点 無視できる程度の差 三重点 : 三つの異なる相が全部同時に平衡で共存可能な温度、圧力条件物質 融点 沸点 鉄 1535 2754 銅 1085 2580 アルミニウム 660 2486 鉛 328 1750 食塩 801 1467 水銀 39 357 ナフタレン融点と凝固点は同じ温度で、パルミチン酸は63度Cです。 この測定方法は2時間前に行った『 実験16 エタノールの沸点 』と同じなので、生徒は良好なデータを簡単に得ることができたと思います。




3 4 について教えていただきたいです Clear




なぜ融点や沸点は物質によって違うのか
融点測定試料の例として21 に挙げた物質の融点は表1 のとおりである。ただし,これらは試料が純粋な場合の値 であり,扱っている試料の純度が低ければ融点は低めにな る。パルミチン酸の場合,学校で使う薬品だと60 ℃くら いを示すことが多い。原子番号 元素記号 元素名 英語名 原子量 密度 g/cm3 融点 ℃ 沸点 ℃ 族・グループ融点(ゆうてん、独 Schmelzpunkt 、仏 point de fusion 、英 melting point )とは、固体が融解し液体になる時の温度のことをいう。 ヒステリシスが無い場合には凝固点(液体が固体になる時の温度)と一致する。 また、三重点すなわち平衡蒸気圧下の融点は物質固有の値を取り、不純物が含まれて




これらのグラフの特徴みたときに Cがずば抜けて高いなと感じたのですが なぜですか Clear




状態変化04 Youtube




状態図とは 見方 例 水 鉄 理系ラボ




高校化学 同素体 融点と溶解度の推測方法 H2oがhfより沸点が高い理由を簡単に解説 高校化学選択をしている受験生や高校生は必見 弁理士を目指すブログ



融点と沸点



1 2 4 水の注目すべき特性 3 融点 沸点 水の話




中1理科 3分でわかる 沸点と融点の違い Qikeru 学びを楽しくわかりやすく



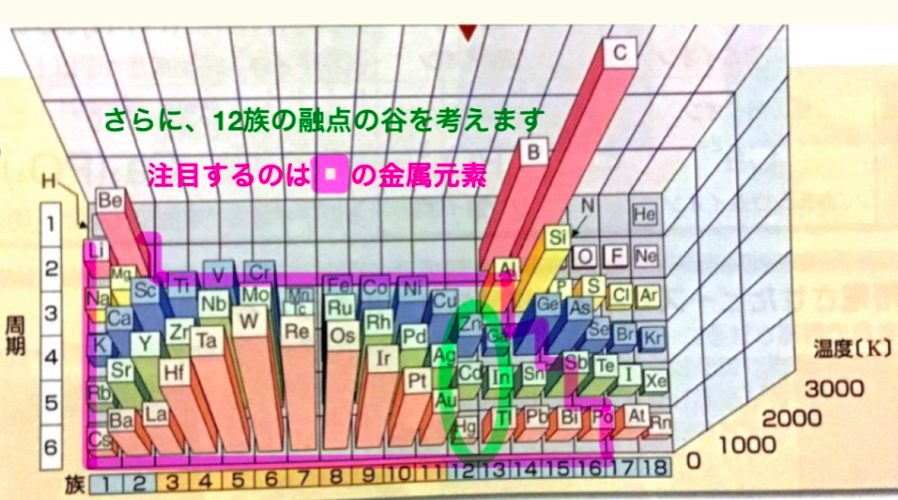
第1節 周期表と元素の性質



アルカンの融点




融点と沸点 宇宙人を探しに エウロパとタイタンへ Menon Network



なんで水銀は常温で液体なの ーなんとか答えます 高校化学の教材 分子と結晶模型の ベンゼン屋 楽天ブログ




水の状態変化 沸点 融点 中1 理科 1分野 身のまわりの物質13 Youtube




2 D165 Descubre Como Resolverlo En Qanda




中1理科 3分でわかる 沸点と融点の違い Qikeru 学びを楽しくわかりやすく




融点



化学講座 第8回 水素結合と水の性質 私立 国公立大学医学部に入ろう ドットコム



中1化学 蒸留 中学理科 ポイントまとめと整理




融点 沸点 1 2 4 水の注目すべき特性 3 融点 沸点 水の話 Amp Petmd Com



高校化学 キーワードで理解する化学結合と融点 沸点 定額個別指導塾の櫻学舎 仙台五橋 家での勉強が1時間未満の子の為の学習塾



中1理科 状態変化 温度の変化 Pikuu



融点と沸点




中1理科 3分でわかる 沸点と融点の違い Qikeru 学びを楽しくわかりやすく




これらのグラフの特徴みたときに Cがずば抜けて高いなと感じたのですが なぜですか Clear
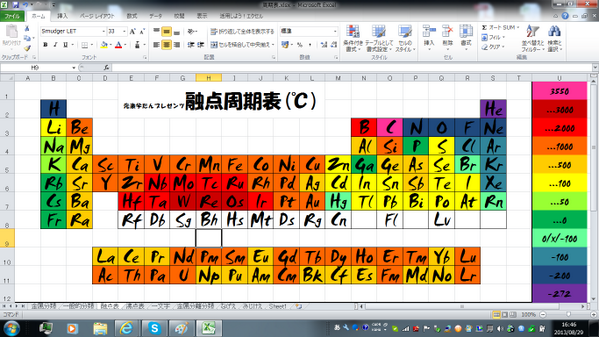



元素学たん 5 17元素本発売 בטוויטר 融点周期表 各元素の融点を色で表した融点周期表よ Wやreを中心にして放射状に融点が下がっていく様子が視覚的にわかるんじゃないかしら Http T Co Sw6cs1lyvn



融点 沸点 1 2 4 水の注目すべき特性 3 融点 沸点 水の話 Amp Petmd Com




なぜ融点や沸点は物質によって違うのか 高校生向け
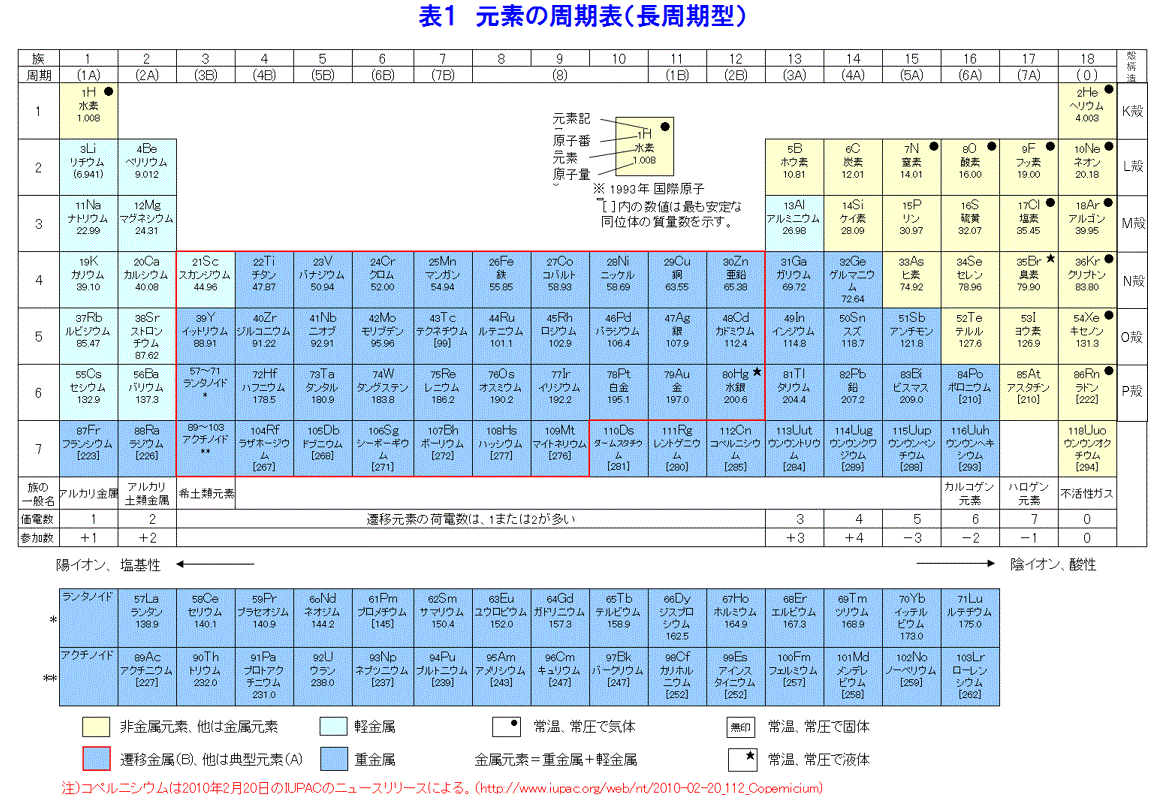



元素の周期表 物性 18 02 01 01 Atomica



融点が上昇したり沸点が降下することはありえますか 下図が水の状態図です Yahoo 知恵袋




5分でわかる 沸点 融点 凝固点 を元家庭教師が解説 Study Z ドラゴン桜と学ぶwebマガジン
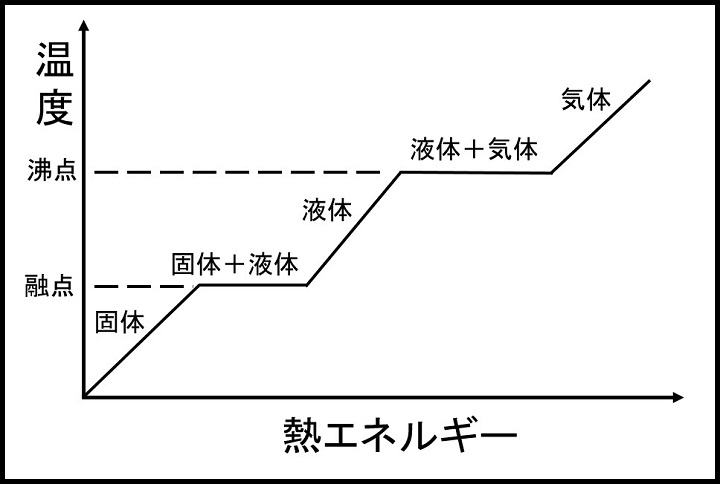



物質の状態変化とは 水での例や融点 沸点と一緒に徹底解説 とはとは Net




高校化学 アルカンの性質 映像授業のtry It トライイット
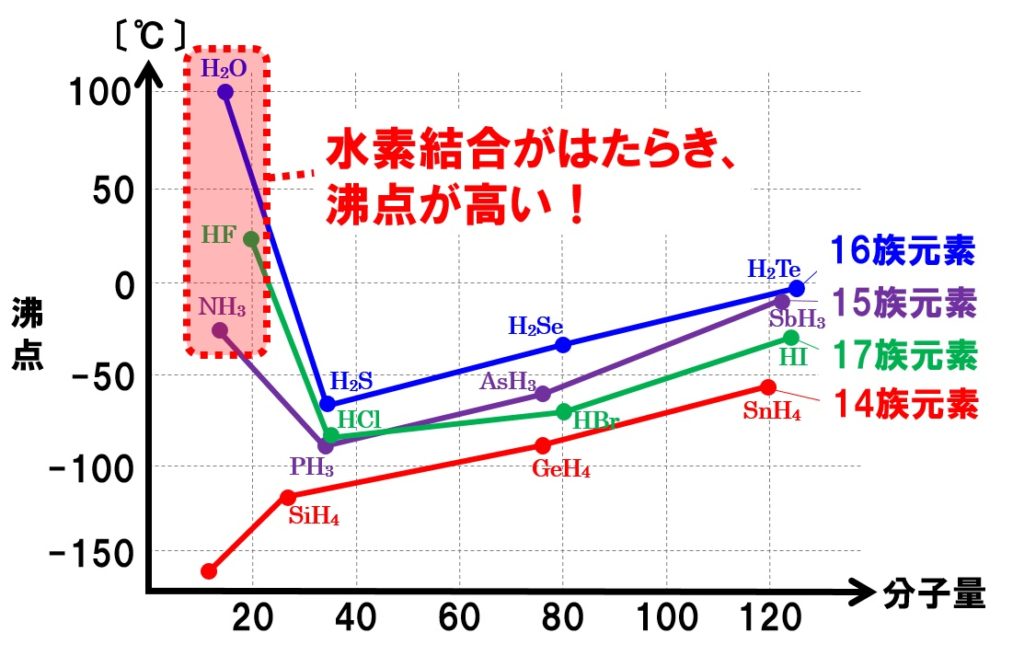



高校化学 物質の状態 物質の三態と分子間力 Tekibo



状態変化と温度 固体 液体 気体 の達人
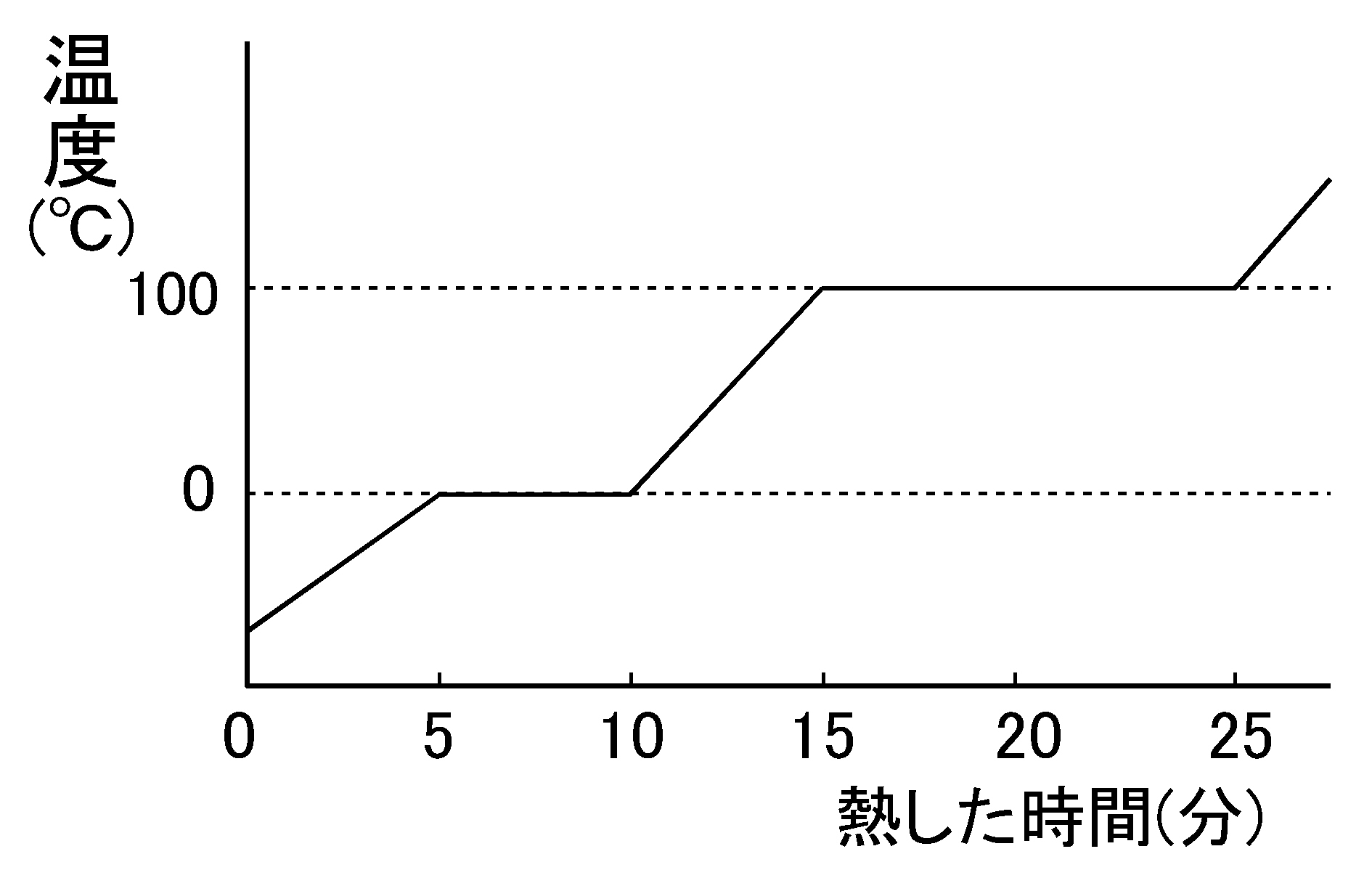



Wordで使える 中学理科 沸点と融点のグラフ 中学理科の計算問題ドリルをwordで作ろう
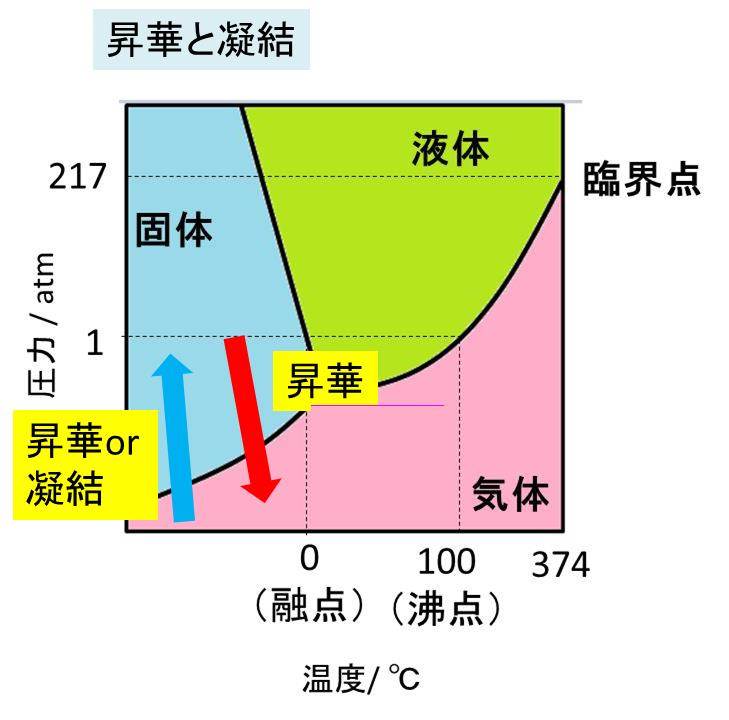



昇華性物質の代表例は 融点はどのくらい 状態図との関係は




高校化学 アルカンの性質 映像授業のtry It トライイット
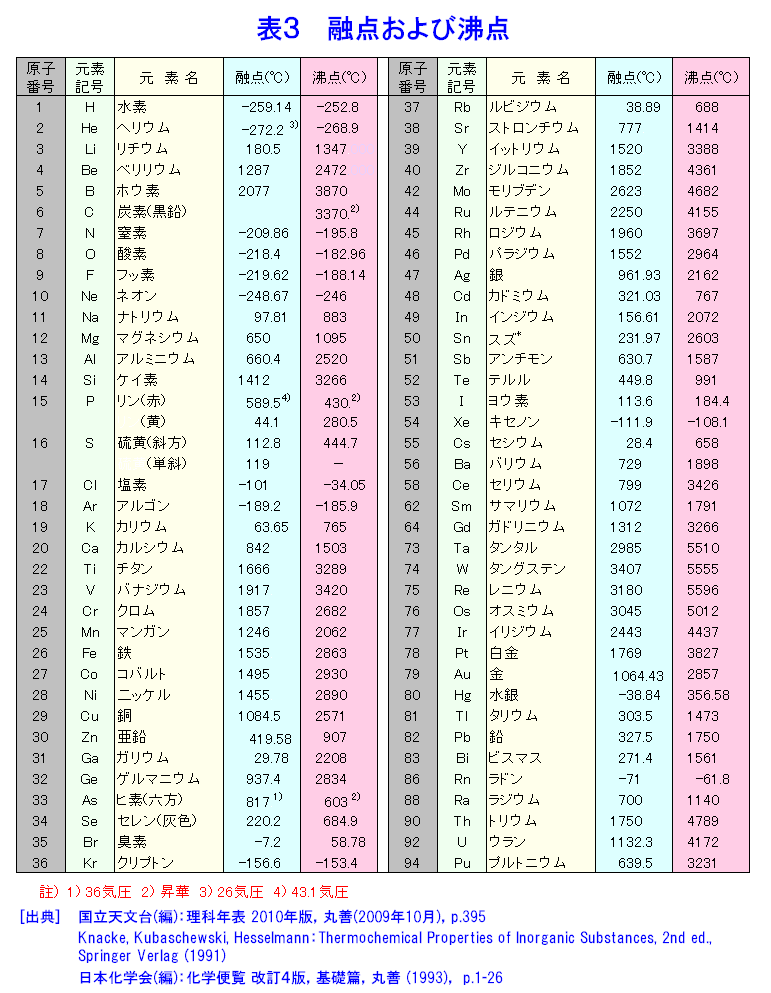



融点および沸点



化学結合と温度




融点と沸点 宇宙人を探しに エウロパとタイタンへ Menon Network




水の状態変化と状態図 融点 沸点 三重点 臨界点 高校化学 Irohabook
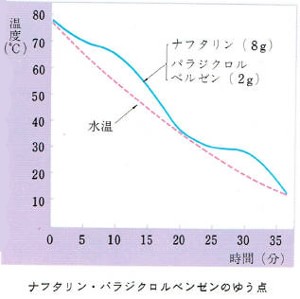



混合物の沸点と融点とは わかりやすく解説 科学をわかりやすく解説




融点 沸点 塾の質問箱



物質の融点や沸点はどのように決まるのでしょうか 原子の構造から融点や沸点を予測することはできるのでしょうか Quora



状態変化 印刷用まとめ




直鎖アルコール 融点沸点一覧 戯言



State Energy Melting Point Boiling Point




中1理科 3分でわかる 沸点と融点の違い Qikeru 学びを楽しくわかりやすく



あれれ この融点沸点のところは大小逆ですか Yahoo 知恵袋




物質の状態変化




小 中必見 化学を勉強する前に第5弾 物質の三態について 学習内容解説ブログ




融点 沸点 1 2 4 水の注目すべき特性 3 融点 沸点 水の話 Amp Petmd Com




高校化学 物質の状態と平衡03 結合と沸点 融点 7分 Youtube
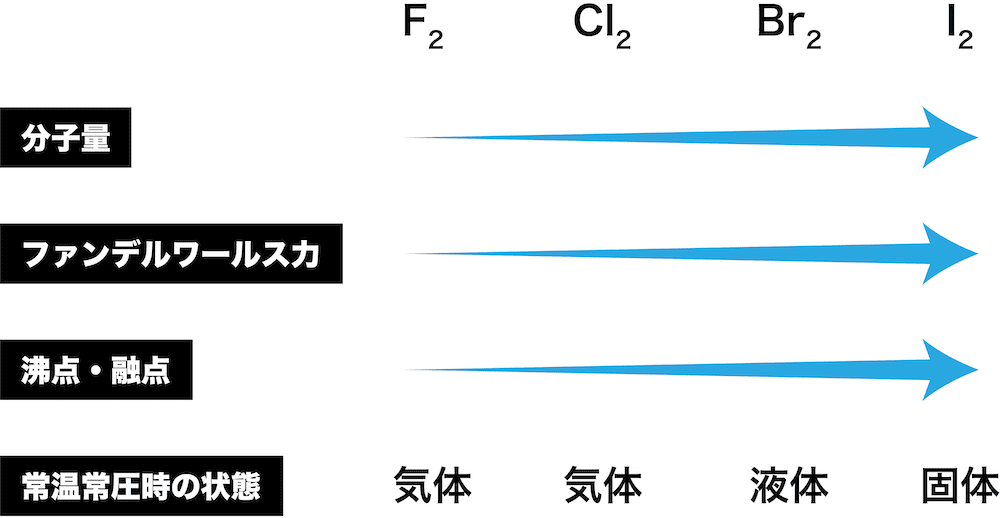



ハロゲン単体 ハロゲン化水素の性質 製法 化学のグルメ




高校化学 物質の結合と融点 映像授業のtry It トライイット



沸点と融点 オフィス 宮島の理科一問一答 Welcome To Office Miyajima Web Site



3



3
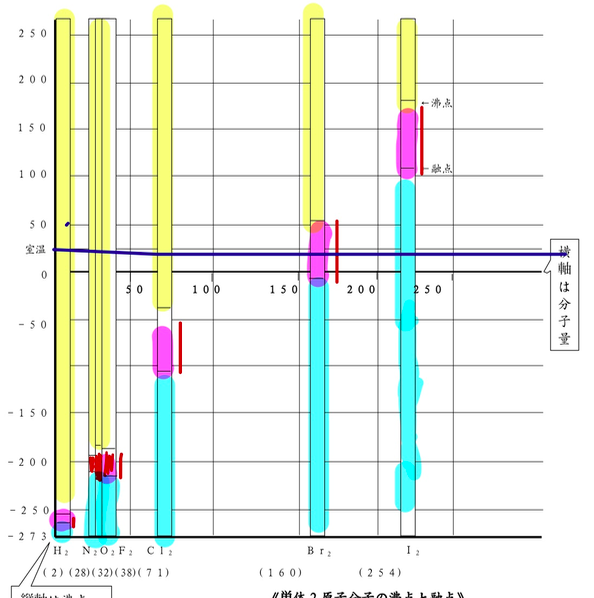



補習 見えない粒を見る 化学実験講義2日目 高校化学の教材 分子と結晶模型の ベンゼン屋 楽天ブログ




菊 少し余談



状態変化と温度 固体 液体 気体 の達人
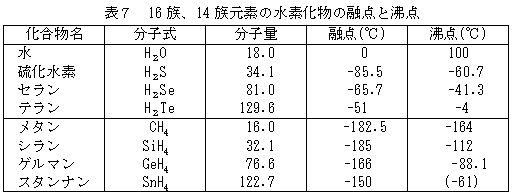



1 2 4 水の注目すべき特性 3 融点 沸点 水の話




2 D165 Descubre Como Resolverlo En Qanda




沸点 Wikipedia
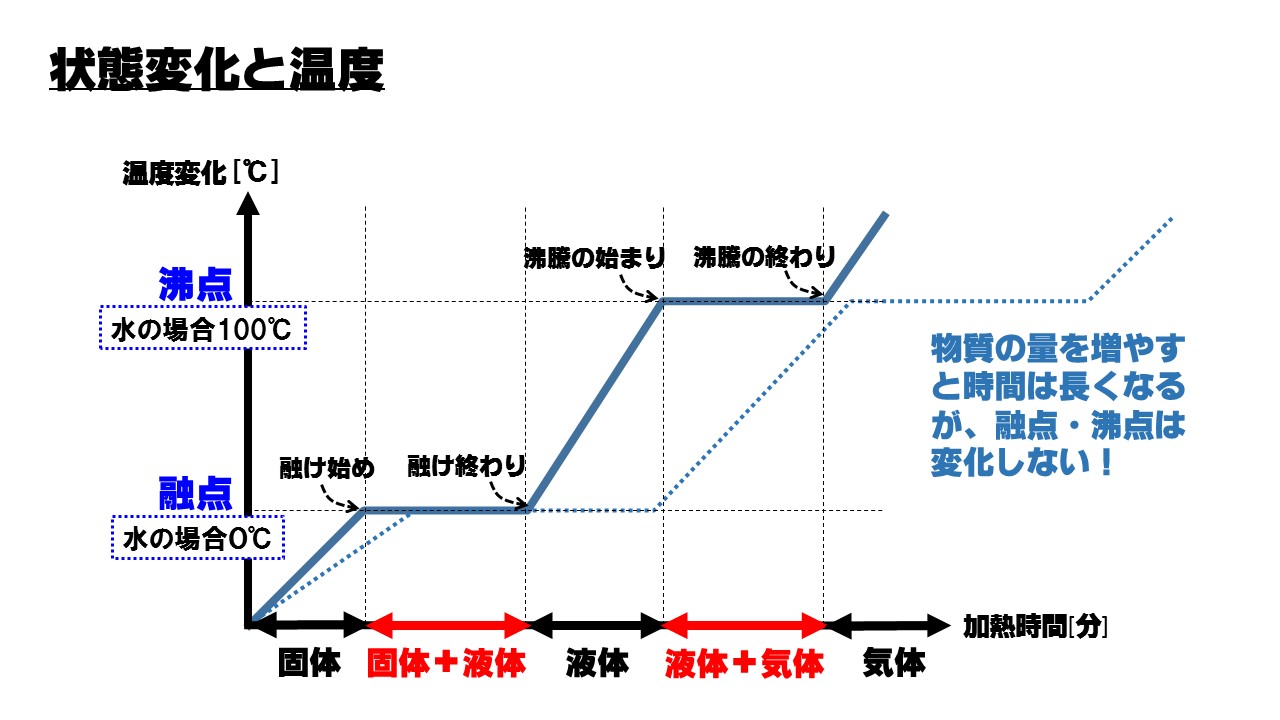



中1理科 物質の状態変化のポイントまとめ Atstudier



融点と沸点




この問題の沸点の高い 低いはどうやったら わかるのですか 教えてください Clear
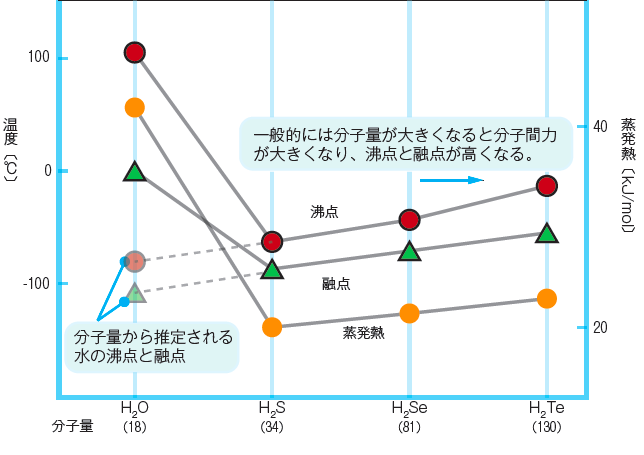



水の科学10 水分子同士は水素結合で結ばれる Aqua Sphere
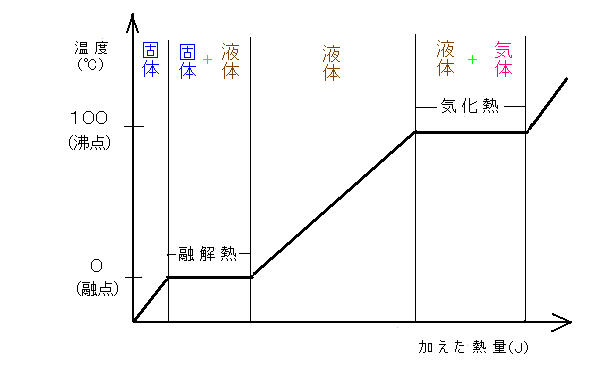



潜熱
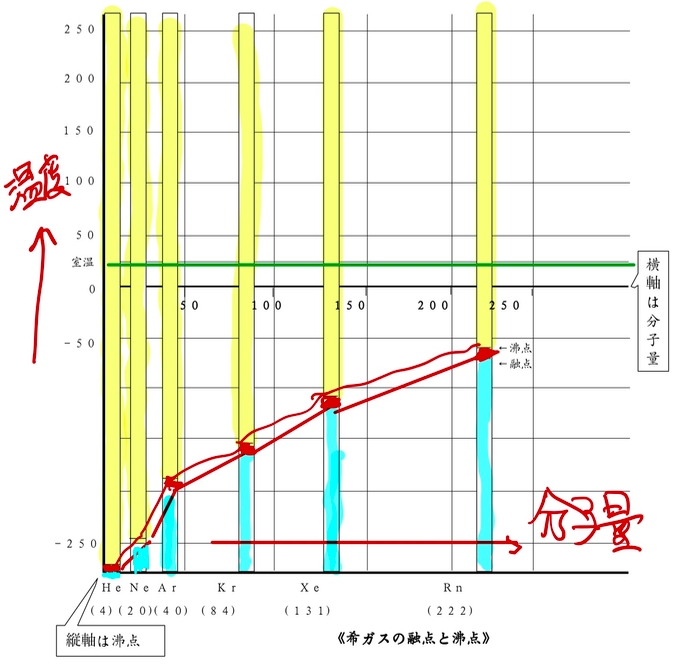



補習 見えない粒を見る 化学実験講義2日目 高校化学の教材 分子と結晶模型の ベンゼン屋 楽天ブログ
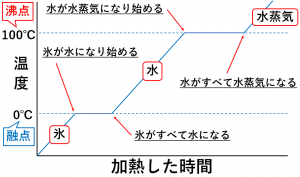



中1理科 状態変化 状態変化と温度 蒸留について理解しよう たけのこ塾 勉強が苦手な中学生のやる気をのばす




融点と沸点 宇宙人を探しに エウロパとタイタンへ Menon Network




なぜ融点や沸点は物質によって違うのか



1
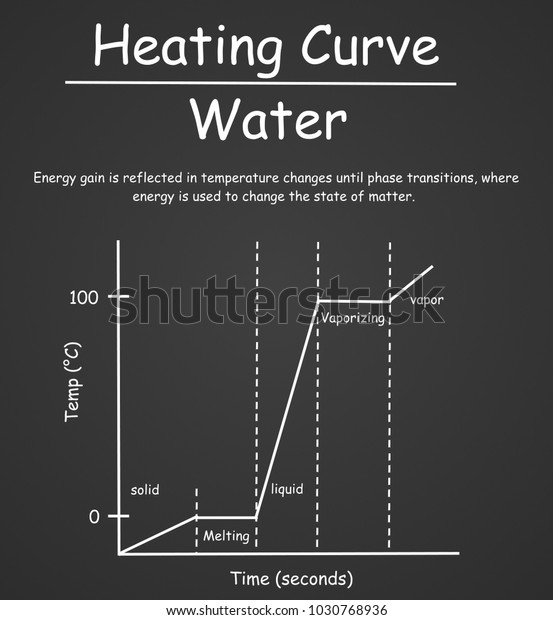



融点と沸点を通る水の加熱曲線 のイラスト素材
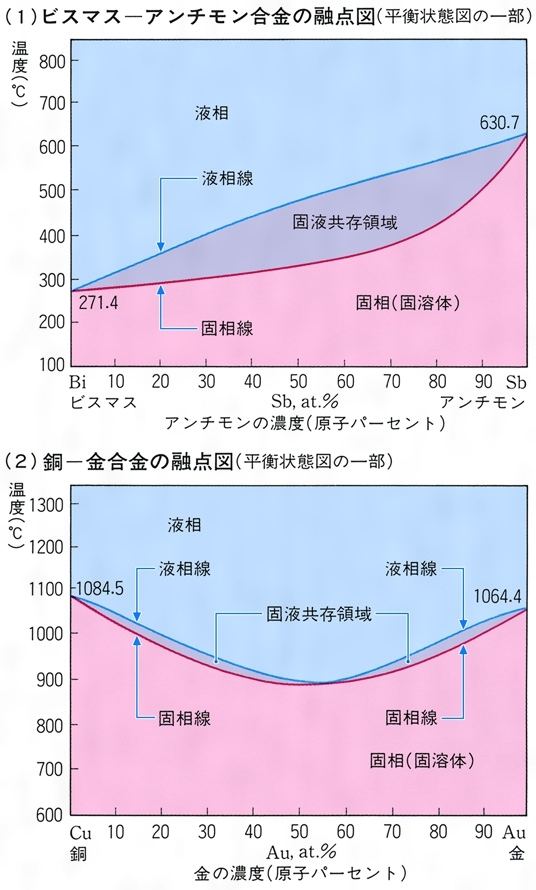



融点とは コトバンク




融点 沸点 1 2 4 水の注目すべき特性 3 融点 沸点 水の話 Amp Petmd Com




Ad C 9c Descubre Como Resolverlo En Qanda




小 中必見 化学を勉強する前に第5弾 物質の三態について 学習内容解説ブログ



脂肪族炭化水素 アルカン




2 P126 A E Left Cright Descubre Como Resolverlo En Qanda




融点と沸点 宇宙人を探しに エウロパとタイタンへ Menon Network




物質の状態変化 融解 凝固 と反応熱の関係を元塾講師が解説 Study Z ドラゴン桜と学ぶwebマガジン




Ae Descubre Como Resolverlo En Qanda
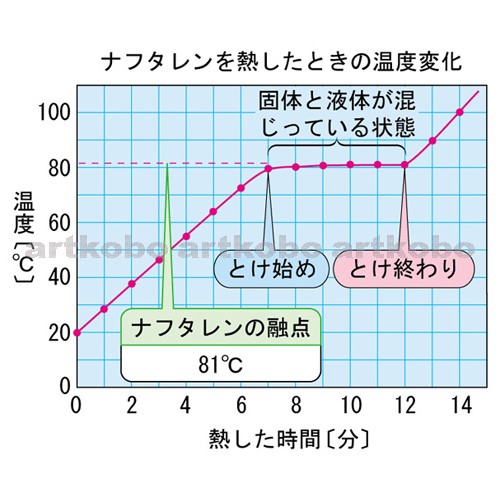



Web教材イラスト図版工房 状態変化と温度 沸点 融点




なぜ融点や沸点は物質によって違うのか



1




沸点 Wikipedia




物質の状態変化ーグラフなどの問題 無料で使える中学学習プリント
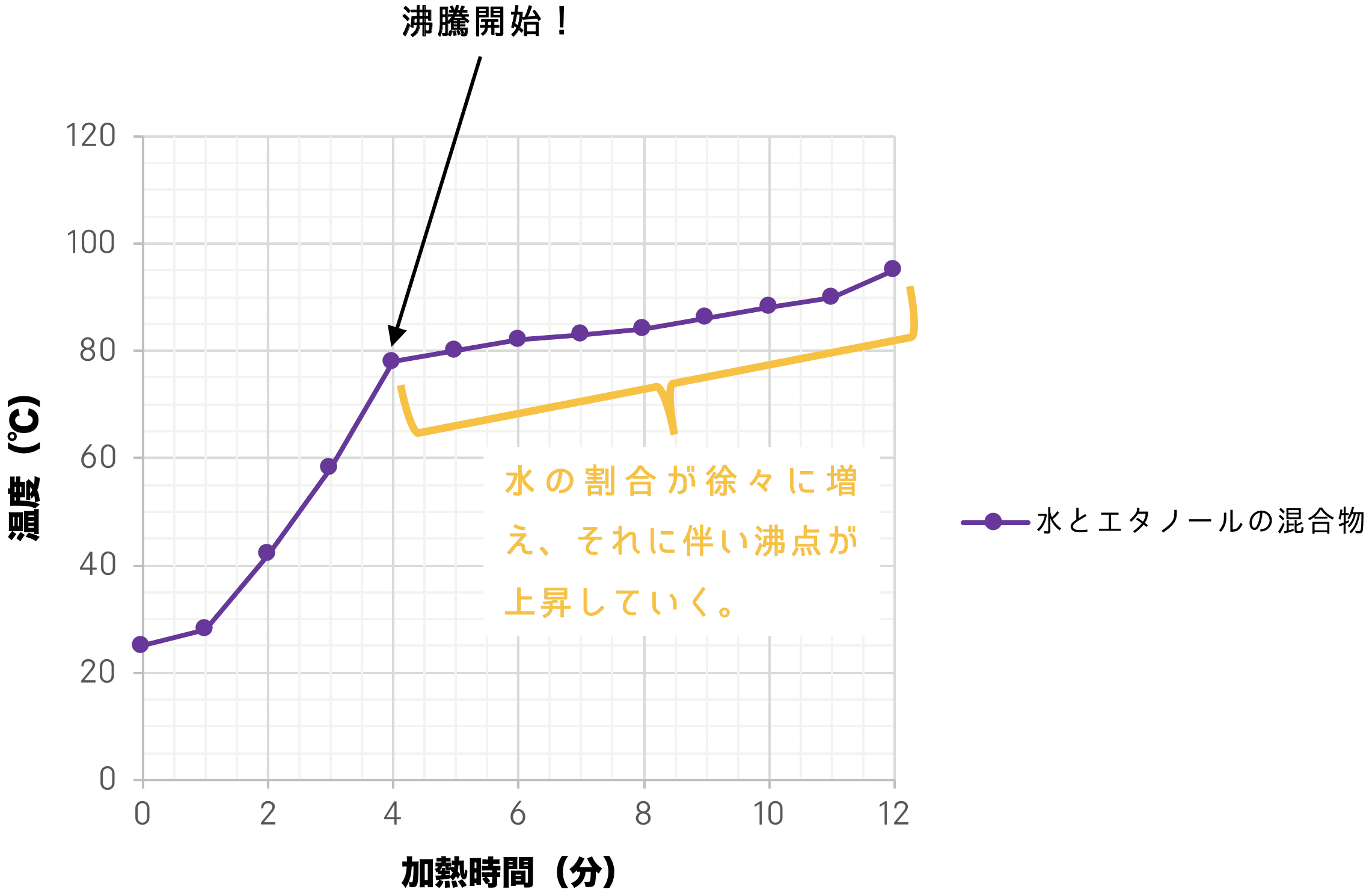



純物質と混合物 定義 違い 見分け方 例など 化学のグルメ




Wolfram Alpha Japan Sur Twitter 周期表で元素の性質まで同時に見られたら便利だと思いませんか そんなときはwolfram Alpha T Co Jcodviz6ak 結果右上のボタンで 質量や沸点 融点 電気陰性度 発見年など 表示の切替えができます Wolframalpha



Www Pref Kanagawa Jp Documents 6 4 Pdf
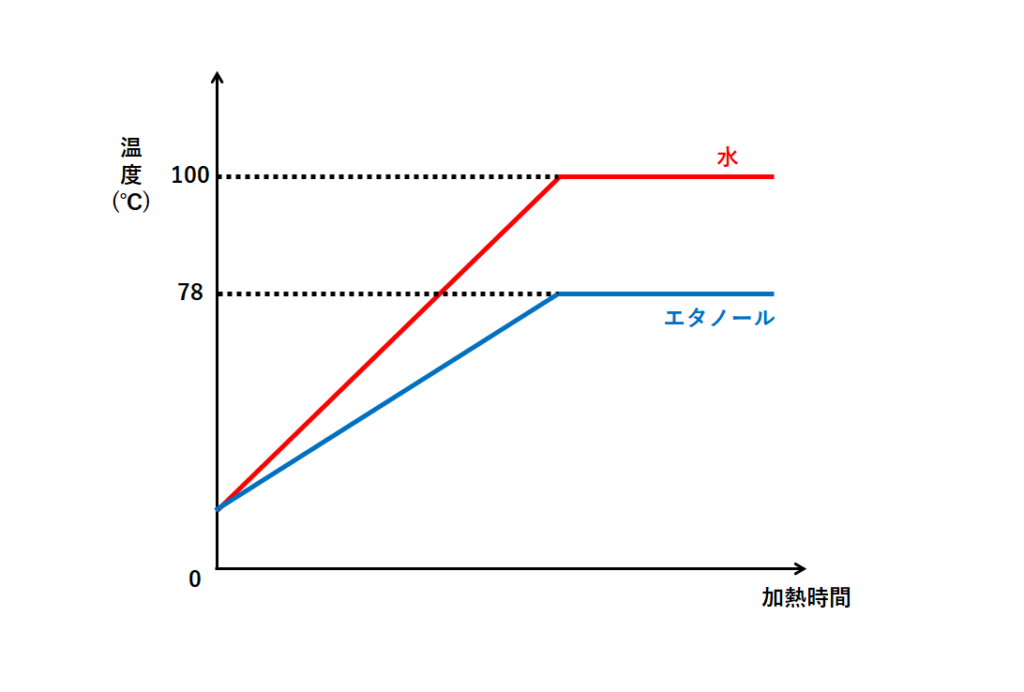



融点 沸点 1 2 4 水の注目すべき特性 3 融点 沸点 水の話 Amp Petmd Com




化学基礎 分子間力と沸点 Youtube
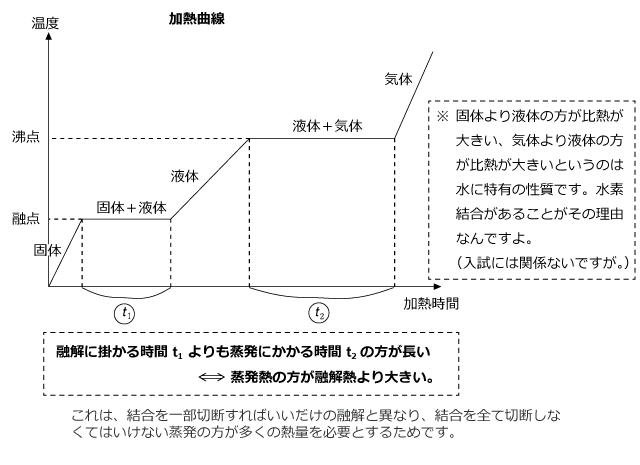



化学講座 第46回 凝固点降下 私立 国公立大学医学部に入ろう ドットコム




沸点 Wikipedia




理科年表オフィシャルサイト Faq 物理 化学部 固体 液体 気体の状態を教えてください



0 件のコメント:
コメントを投稿